【问答揭秘】怎样正确书写电子式?一步一步教你轻松掌握!
在我们探索化学世界的奥秘时,电子式作为一种直观展示原子间成键关系及电子排布的工具,扮演着举足轻重的角色。它不仅帮助化学学习者理解物质的构成,还促进了化学反应机理的研究。那么,如何书写电子式呢?接下来,我们就以通俗易懂的方式,一步步揭开这个化学“密码”的面纱。
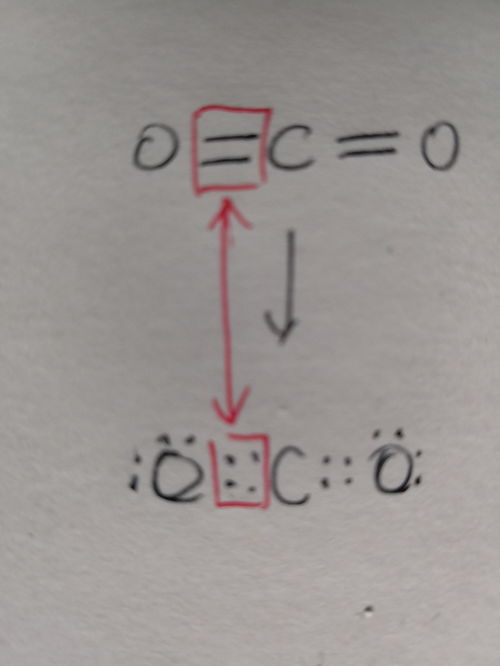
一、认识电子式:化学世界的“简笔画”
首先,想象一下,如果每个原子都是一个小小的星球,而围绕它旋转的电子就像是星球周围的卫星,那么电子式就是这些星球(原子)与卫星(电子)分布情况的“简笔画”。它用小黑点(·)或叉号(×)代表原子最外层的电子,通过这些符号的组合与排列,展现了原子间如何通过共享或转移电子形成化学键,进而构成分子的过程。

二、基础准备:了解原子结构与电子排布
在书写电子式之前,我们需要对原子的基本结构和电子排布有一定的了解。每个原子都由位于中心的原子核和围绕其运动的电子组成。原子核带正电,电子带负电,且电子总是尽可能地排布在能量最低的轨道上,形成稳定的电子层结构。对于大多数元素而言,最外层电子的排布情况决定了其化学性质。

三、书写规则:循序渐进,步步为营
1. 单独原子的电子式
原则:首先确定原子的电子总数(即其原子序数),然后根据电子排布规律,将最外层的电子以小黑点或叉号的形式标出。
示例:以氢原子(H)为例,其原子序数为1,意味着它只有一个电子。因此,氢原子的电子式就是“H·”(或“H×”,叉号与点可互换使用,习惯上多用点)。
2. 共价化合物的电子式
原则:共价化合物是通过原子间共享电子来形成的。书写时,应体现出各原子如何通过共享电子达到稳定结构(即最外层电子数为8或2,对于氢和氦等稀有气体元素为2)。
步骤:
1. 写出各原子的最外层电子数。
2. 通过共用电子对(一对共用电子由两个小黑点或叉号表示,且连接两个原子)连接原子,直至所有原子都达到稳定结构。
3. 注意,共用电子对由两个原子共同享有,不计入任一原子的电子总数统计中。
示例:水的电子式。氢原子最外层有1个电子,氧原子最外层有6个电子。通过共享电子对,两个氢原子和一个氧原子结合成水分子,使得每个氢原子都达到了2电子的稳定结构,而氧原子达到了8电子的稳定结构。因此,水的电子式为`H:O:H`(注意,这里的冒号`:`表示共用电子对,有时也直接用两个点表示,如`H··O··H`)。
3. 离子化合物的电子式
原则:离子化合物是通过离子键(即电子的完全转移)形成的。书写时,需明确哪些原子会失去电子成为阳离子,哪些原子会获得电子成为阴离子。
步骤:
1. 分别写出阳离子和阴离子的电子式。阳离子用方括号`[]`括起,并在右上角标出所带电荷数;阴离子则直接写出,并在右上角标出负号及电荷数(如果电荷数为1,负号可省略)。
2. 通过离子键(通常用实线`-`表示)将阴阳离子连接起来,构成离子化合物的电子式。
示例:氯化钠的电子式。钠原子(Na)失去一个电子成为`Na⁺`阳离子,氯原子(Cl)获得一个电子成为`Cl⁻`阴离子。它们通过离子键结合成氯化钠,电子式为`Na⁺[ :Cl: ]⁻`(方括号内的`:Cl:`表示氯离子,外层的点表示其获得的电子,方括号和电荷数标明了离子状态)。
四、进阶技巧:应对复杂分子与特殊情况
复杂分子:对于包含多个原子和复杂化学键的分子,需要仔细分析每个原子的电子排布和它们之间的成键方式,逐步构建出整个分子的电子式。
特殊情况:有些元素(如过渡金属)的电子排布较为复杂,且常涉及d轨道和f轨道的电子参与成键,此时需要根据具体情况灵活处理。此外,一些特殊的化学键(如配位键、大π键等)也需要特别注意其电子式的书写方式。
五、总结与反思
书写电子式是化学学习中的一项基本技能
- 上一篇: 华为手机如何隐藏应用图标,保护隐私?
- 下一篇: 苹果手机中的'启用WAPI'功能是什么,有什么作用?
-
 轻松学会!一步一步教你画蝙蝠资讯攻略11-17
轻松学会!一步一步教你画蝙蝠资讯攻略11-17 -
 苹果手机如何轻松下载安装APP软件?一步一步教你搞定!资讯攻略10-26
苹果手机如何轻松下载安装APP软件?一步一步教你搞定!资讯攻略10-26 -
 微信青少年模式开启秘籍:一步一步教你搞定!资讯攻略01-06
微信青少年模式开启秘籍:一步一步教你搞定!资讯攻略01-06 -
 轻松上手!一步一步教你如何开通公众号资讯攻略10-26
轻松上手!一步一步教你如何开通公众号资讯攻略10-26 -
 苹果手机轻松激活教程,一步一步教你完成!资讯攻略11-19
苹果手机轻松激活教程,一步一步教你完成!资讯攻略11-19 -
 如何轻松注销QQ空间账号?一步一步教你操作!资讯攻略10-27
如何轻松注销QQ空间账号?一步一步教你操作!资讯攻略10-27












