金刚石和石墨的化学式分别是什么
金刚石和石墨,作为碳元素的同素异形体,长久以来一直吸引着科学家和普通人的好奇心。它们都是由碳原子组成,但物理性质却截然不同,这一奇特现象激发了无数人对它们化学式的探索欲望。那么,金刚石和石墨的化学式究竟是什么?让我们一同揭开这个谜团。

首先,我们要明确的是,金刚石和石墨的化学式都是由碳原子(C)构成的。然而,它们的晶体结构却大不相同,这导致了它们在硬度、导电性、光泽等方面的巨大差异。

金刚石,被誉为自然界中最硬的物质,其化学式可以简单地表示为C。这里的C不仅代表碳元素,更揭示了金刚石是由纯粹的碳原子通过一种特殊的共价键方式排列而成的。在金刚石中,每个碳原子都与周围的四个碳原子通过共价键相连,形成了一个四面体的结构。这些四面体在空间中以连续的方式排列,形成了一种极其紧密且稳定的晶体结构。这种结构赋予了金刚石极高的硬度和耐磨性,使其成为切割、磨削等工业领域不可或缺的材料。

值得注意的是,尽管金刚石是由纯碳组成的,但其形成条件却极为苛刻。在自然界中,金刚石通常是在地球深处的高温高压环境下形成的。这种极端的条件使得碳原子能够以一种特殊的方式排列,从而形成具有极高硬度的金刚石。

与金刚石相比,石墨则显得“柔软”得多。石墨的化学式同样可以表示为C,但其晶体结构却与金刚石截然不同。在石墨中,碳原子以层状结构排列,每一层内的碳原子都通过共价键相连,形成了一个平面六边形的网格结构。而相邻的层之间则通过较弱的范德华力相互作用。这种层状结构使得石墨在受到外力作用时容易发生层与层之间的滑动,从而表现出较低的硬度和良好的润滑性。
除了硬度上的差异外,金刚石和石墨在导电性方面也表现出明显的不同。金刚石由于其紧密的晶体结构,使得电子在其中难以自由移动,因此表现出较差的导电性。而石墨则因为其层状结构中存在自由电子,这些电子可以在层内自由移动,从而使得石墨具有良好的导电性。
此外,金刚石和石墨在光泽和颜色上也存在显著差异。金刚石以其耀眼的光泽和璀璨的色彩而闻名于世,它不仅可以呈现出透明、无色或略带黄色的外观,还可以因为含有其他元素或杂质而呈现出蓝色、绿色、红色等多种颜色。而石墨则通常呈现出黑色或深灰色的外观,其光泽也相对较为暗淡。
在应用领域上,金刚石和石墨也各有千秋。金刚石因其极高的硬度和耐磨性而被广泛应用于切割、磨削、钻探等工业领域。此外,金刚石还因其良好的光学性质和热稳定性而被用于制造高精度光学元件和高温高压环境下的传感器等。而石墨则因其良好的导电性、润滑性和耐高温性而被广泛应用于电池、电极、润滑剂、耐高温材料等领域。
有趣的是,尽管金刚石和石墨在物理性质上存在着巨大的差异,但它们之间的转化却是可能的。在一定条件下,金刚石可以转化为石墨;同样地,石墨也可以在一定条件下转化为金刚石。这种转化过程通常涉及到高温高压或化学气相沉积等特殊条件和技术手段。
值得一提的是,近年来科学家们还发现了碳元素的其他同素异形体,如富勒烯、碳纳米管和石墨烯等。这些新型碳材料在物理性质和应用领域上都展现出了独特的优势和发展潜力。例如石墨烯作为一种二维碳材料,因其出色的电学性能、力学性能和热学性能而备受关注,被认为是未来材料科学领域的重要发展方向之一。
总的来说,金刚石和石墨作为碳元素的同素异形体,在化学式上虽然都表示为C,但它们的晶体结构、物理性质和应用领域却截然不同。这种差异不仅激发了科学家们对它们深入研究的兴趣,也为人类社会的发展进步提供了宝贵的材料和资源。随着科学技术的不断发展进步,相信未来我们还将发现更多碳元素的新型同素异形体,并为人类社会带来更多的惊喜和贡献。
对于那些对金刚石和石墨化学式感兴趣的朋友来说,了解它们的晶体结构和物理性质无疑是打开了一扇通往神奇世界的大门。希望通过这篇文章能够帮助大家更好地认识和理解这两种神奇的碳元素同素异形体,并激发大家对科学探索的热情和兴趣。
- 上一篇: 轻松应对滞涨:有效解决方案大揭秘
- 下一篇: 肠粉怎么做才家常?
-
 揭秘:金刚石背后的神奇化学式是什么?资讯攻略11-05
揭秘:金刚石背后的神奇化学式是什么?资讯攻略11-05 -
 CBN的含义是什么资讯攻略02-15
CBN的含义是什么资讯攻略02-15 -
 四大天王与八大金刚分别是哪些人物资讯攻略11-03
四大天王与八大金刚分别是哪些人物资讯攻略11-03 -
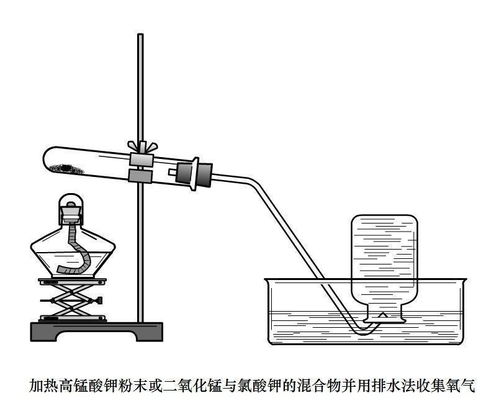 实验室制氧气的三种方法分别是什么,对应的化学方程式是怎样的?资讯攻略11-14
实验室制氧气的三种方法分别是什么,对应的化学方程式是怎样的?资讯攻略11-14 -
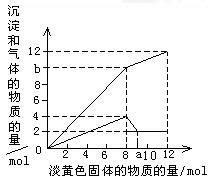 氧化铜的颜色是什么资讯攻略11-21
氧化铜的颜色是什么资讯攻略11-21 -
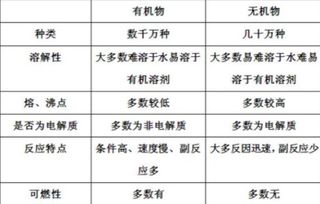 轻松掌握!无机物与有机物的区分方法资讯攻略12-06
轻松掌握!无机物与有机物的区分方法资讯攻略12-06












