实验室如何制取氧气的方法是什么?
在探讨实验室如何制取氧气的过程中,我们首先需要了解氧气的化学性质及其在自然界和工业领域中的重要性。氧气(O₂)是一种无色无味的气体,具有高度的助燃性和氧化性,是生命维持不可或缺的元素之一。在实验室中,制取氧气的方法多种多样,其中最常见的包括分解过氧化氢、加热高锰酸钾以及加热氯酸钾与二氧化锰的混合物。这些方法的选择往往取决于实验条件、所需氧气的纯度以及操作的安全性。
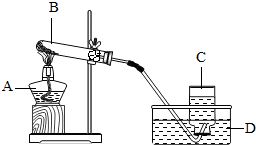
方法一:分解过氧化氢制取氧气

过氧化氢(H₂O₂)是一种绿色氧化剂,其水溶液在常温下即可缓慢分解产生氧气,但在催化剂存在下分解速率会显著提高。实验室常用二氧化锰(MnO₂)作为催化剂来加速过氧化氢的分解。
具体操作步骤如下:
1. 准备器材:分液漏斗、烧瓶、导管、集气瓶、水槽等。
2. 取适量过氧化氢溶液(通常为30%浓度)倒入烧瓶中。
3. 加入少量二氧化锰粉末作为催化剂。
4. 将导管的一端插入烧瓶内,另一端放入水槽中,准备收集产生的氧气。
5. 打开分液漏斗的活塞,使过氧化氢溶液缓慢滴入烧瓶。
6. 观察到导管口有气泡冒出,即为产生的氧气。通过调整滴加速度,可以控制氧气的产生速率。
7. 收集到一定量的氧气后,关闭分液漏斗的活塞,移出集气瓶进行后续实验或保存。
该方法的优点是操作简便、反应速度快且无需加热,但制得的氧气中可能含有少量的水蒸气和其他杂质,需进一步干燥和纯化。
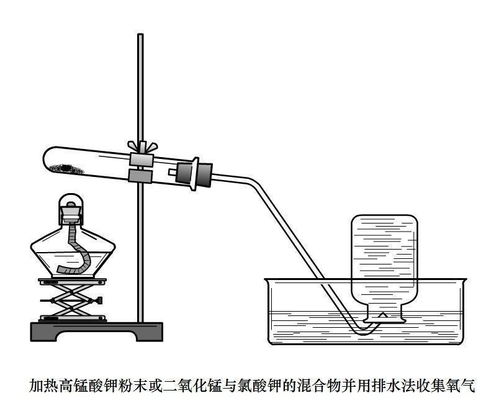
方法二:加热高锰酸钾制取氧气
高锰酸钾(KMnO₄)是一种强氧化剂,加热时会分解产生氧气、锰酸钾(K₂MnO₄)和二氧化锰。该反应需要较高的温度才能进行,且产生的氧气较为纯净。
具体操作步骤如下:
1. 准备器材:试管、酒精灯、铁架台、导管、集气瓶、水槽等。
2. 取适量高锰酸钾粉末放入试管中,并用试管夹固定试管底部。
3. 将导管的一端插入试管内,靠近高锰酸钾粉末但避免直接接触,另一端放入水槽中准备收集氧气。
4. 点燃酒精灯,加热试管底部,使高锰酸钾受热分解。
5. 观察到试管口有气泡冒出,表明氧气正在产生。保持加热,直到不再有大量气泡冒出为止。
6. 收集到足够的氧气后,移走酒精灯,用冷水冷却试管,以防止试管炸裂。
7. 取出集气瓶,进行后续实验或保存。
该方法的优点是制得的氧气纯度高,但操作相对复杂,需要加热且存在一定的安全风险。
方法三:加热氯酸钾与二氧化锰混合物制取氧气
氯酸钾(KClO₃)在二氧化锰催化下加热分解,可产生氧气和氯化钾(KCl)。该方法结合了高锰酸钾法的纯度高和过氧化氢法的操作简便性。
具体操作步骤如下:
1. 准备器材:试管、酒精灯、铁架台、导管、集气瓶、水槽等。
2. 取适量氯酸钾粉末和少量二氧化锰粉末混合均匀,放入试管中。
3. 用试管夹固定试管底部,并将导管的一端插入试管内,靠近混合物但避免直接接触,另一端放入水槽中准备收集氧气。
4. 点燃酒精灯,加热试管底部,使混合物受热分解。
5. 观察到试管口有气泡冒出,表明氧气正在产生。保持加热,直到不再有大量气泡冒出为止。
6. 收集到足够的氧气后,移走酒精灯,用冷水冷却试管。
7. 取出集气瓶,进行后续实验或保存。
该方法的优点是制得的氧气纯度高且操作相对简便,但同样需要加热且存在一定的安全风险。
安全注意事项
在进行上述实验时,必须严格遵守实验室安全规则,以防意外事故的发生。
1. 实验前应检查所有仪器是否完好无损,特别是试管、导管等玻璃仪器是否有裂纹或破损。
2. 实验过程中应佩戴防护眼镜和手套,以防化学品溅入眼睛或皮肤。
3. 加热试管时,应使用试管夹固定试管底部,以防试管滑落或炸裂。
4. 收集氧气时,应将导管插入水槽中,以防氧气逸散到空气中。
5. 实验结束后,应及时熄灭酒精灯并冷却试管,以防火灾或炸裂。
6. 实验过程中应注意观察实验现象,并记录相关数据。
7. 若发生意外情况,如化学品溅入眼睛或皮肤、试管炸裂等,应立即停止实验并寻求教师或实验室工作人员的帮助。
结论
实验室制取氧气的方法多种多样,包括分解过氧化氢、加热高锰酸钾以及加热氯酸钾与二氧化锰的混合物等。这些方法各有优缺点,应根据实验需求和安全考虑进行选择。在实际操作中,应严格遵守实验室安全规则,确保实验过程的安全和顺利进行。通过不断优化实验方法和条件,我们可以进一步提高氧气的制取效率和纯度,为科研和生产提供更多高质量的氧气资源。
- 上一篇: 美图秀秀P图技巧大揭秘:轻松打造完美照片
- 下一篇: 淘宝上购物时如何绑定银行卡?
-
 轻松掌握!制取氧气的6大实用方法详解资讯攻略11-14
轻松掌握!制取氧气的6大实用方法详解资讯攻略11-14 -
 制取氧气的三种化学反应方程式资讯攻略11-14
制取氧气的三种化学反应方程式资讯攻略11-14 -
 实验室制氧气的三种方法分别是什么,对应的化学方程式是怎样的?资讯攻略11-14
实验室制氧气的三种方法分别是什么,对应的化学方程式是怎样的?资讯攻略11-14 -
 实验室如何制取二氧化硫的化学方程式是什么?资讯攻略12-06
实验室如何制取二氧化硫的化学方程式是什么?资讯攻略12-06 -
 揭秘:制取氧气的三大神奇方程式资讯攻略11-14
揭秘:制取氧气的三大神奇方程式资讯攻略11-14 -
 探索实验室制备氧气的三大奇妙途径资讯攻略11-15
探索实验室制备氧气的三大奇妙途径资讯攻略11-15










