制取氧气的三种化学反应方程式
在化学领域,制取氧气是一项基础而重要的实验技能。本文将围绕“制取氧气的三种方法的化学方程式”这一核心主题,详细阐述三种主要的制氧方法及其对应的化学方程式,以期为初学者提供清晰而全面的理解。

制取氧气的三种方法的化学方程式
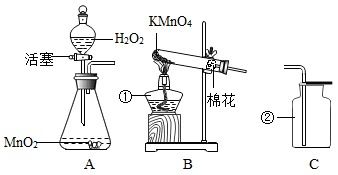
方法一:加热高锰酸钾
高锰酸钾(KMnO₄)是一种紫色晶体,它在加热条件下可以分解产生氧气。这一化学反应的化学方程式为:

\[2KMnO₄ \overset{\Delta}{=} K₂MnO₄ + MnO₂ + O₂↑\]
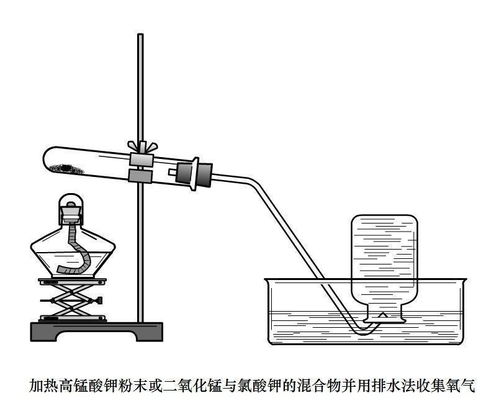
在实验中,通常将高锰酸钾置于试管中,加热试管底部。随着温度的升高,高锰酸钾开始分解,产生锰酸钾(K₂MnO₄)、二氧化锰(MnO₂)和氧气(O₂)。氧气以气泡的形式从试管口逸出,可以被收集起来供后续使用。值得注意的是,在加热过程中,需要确保试管受热均匀,以防止试管因局部过热而破裂。
方法二:加热氯酸钾和二氧化锰的混合物
氯酸钾(KClO₃)在二氧化锰(MnO₂)的催化作用下,加热分解可以产生氧气。这一化学反应的化学方程式为:
\[2KClO₃ \overset{\Delta, MnO₂}{=} 2KCl + 3O₂↑\]
在这一反应中,二氧化锰作为催化剂,能够降低氯酸钾分解所需的活化能,从而加速反应进程。实验时,将氯酸钾和二氧化锰的混合物置于试管中,加热试管底部。随着温度的升高,氯酸钾在二氧化锰的催化作用下开始分解,产生氯化钾(KCl)和氧气(O₂)。同样地,氧气以气泡的形式从试管口逸出,可以被收集起来。在实验过程中,也需要注意试管受热均匀,以及防止冷凝水回流导致试管破裂。
方法三:过氧化氢在二氧化锰催化下分解
过氧化氢(H₂O₂)在二氧化锰的催化作用下,可以分解产生水和氧气。这一化学反应的化学方程式为:
\[2H₂O₂ \overset{MnO₂}{=} 2H₂O + O₂↑\]
过氧化氢分解反应是一个典型的氧化还原反应,其中二氧化锰作为催化剂,加速了过氧化氢的分解。实验时,将过氧化氢溶液倒入试管中,然后加入少量的二氧化锰粉末。在二氧化锰的催化作用下,过氧化氢开始分解,产生水和氧气。氧气以气泡的形式从试管口逸出,可以被收集起来。这一方法相对简单且安全,是实验室中常用的制取氧气的方法之一。
实验操作注意事项
在制取氧气的实验中,除了需要掌握正确的化学方程式外,还需要注意以下几点:
1. 安全操作:在进行化学实验时,务必佩戴好防护眼镜和实验服,以防止化学品溅入眼睛或皮肤。同时,要确保实验环境通风良好,以防止氧气浓度过高导致窒息。
2. 试管加热:在加热试管时,要确保试管受热均匀,以防止试管因局部过热而破裂。此外,还需要注意冷凝水的回流问题,以防止冷凝水回流到试管底部导致试管破裂。
3. 催化剂选择:在实验中,二氧化锰是一种常用的催化剂,能够加速化学反应的进程。然而,在某些情况下,也可以选择其他催化剂,如红砖粉末、土豆、水泥、铁锈等。选择催化剂时,需要根据具体的化学反应和实验条件来确定。
4. 气体收集:在制取氧气的过程中,需要选择合适的收集方法。常用的收集方法有排水法和向上排空气法。排水法适用于不易溶于水的气体,如氧气;而向上排空气法则适用于密度比空气大的气体。在选择收集方法时,需要根据气体的性质来确定。
5. 实验后处理:在实验结束后,需要对实验器材进行清洗和整理。对于剩余的化学药品,需要按照实验室的规定进行处理,以防止对环境和人体造成危害。
制取氧气的其他方法
除了上述三种主要的制氧方法外,还有其他一些方法可以制取氧气。例如,水在直流电的作用下可以分解产生氢气和氧气,这一化学反应的化学方程式为:
\[2H₂O \overset{\text{通电}}{=} 2H₂↑ + O₂↑\]
然而,这一方法需要消耗大量的电能,因此在实验室中并不常用。此外,还有一些工业上制取氧气的方法,如空气分离法等,这些方法通常用于大规模生产氧气。
结论
制取氧气是化学实验中一项基础而重要的技能。本文详细阐述了三种主要的制氧方法及其对应的化学方程式,包括加热高锰酸钾、加热氯酸钾和二氧化锰的混合物以及过氧化氢在二氧化锰催化下分解。同时,还介绍了实验操作注意事项以及制取氧气的其他方法。希望本文能够为初学者提供清晰而全面的理解,帮助他们更好地掌握制取氧气的技能。在未来的学习和实践中,希望读者能够不断探索和创新,为化学领域的发展做出更大的贡献。
- 上一篇: 轻松学会:如何将电脑时间同步到网络时间
- 下一篇: 揭秘'买个der'背后的含义:网络流行语大起底
-
 实验室制氧气的三种方法分别是什么,对应的化学方程式是怎样的?资讯攻略11-14
实验室制氧气的三种方法分别是什么,对应的化学方程式是怎样的?资讯攻略11-14 -
 揭秘:制取氧气的三大神奇方程式资讯攻略11-14
揭秘:制取氧气的三大神奇方程式资讯攻略11-14 -
 轻松掌握!制取氧气的6大实用方法详解资讯攻略11-14
轻松掌握!制取氧气的6大实用方法详解资讯攻略11-14 -
 实验室如何制取二氧化硫的化学方程式是什么?资讯攻略12-06
实验室如何制取二氧化硫的化学方程式是什么?资讯攻略12-06 -
 实验室如何制取氧气的方法是什么?资讯攻略11-14
实验室如何制取氧气的方法是什么?资讯攻略11-14 -
 探索实验室制备氧气的三大奇妙途径资讯攻略11-15
探索实验室制备氧气的三大奇妙途径资讯攻略11-15