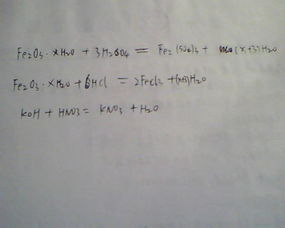实验室如何制取二氧化硫的化学方程式是什么?
在化学实验中,制取二氧化硫是一项常见的操作。二氧化硫(SO₂)是一种无色、有刺激性气味的气体,其化学性质活泼,在实验室中有多种方法可以制取。本文将详细介绍实验室制取二氧化硫的化学方程式及其相关原理和操作。

首先,最常见且简便的方法是利用亚硫酸钠(Na₂SO₃)与浓硫酸(H₂SO₄)反应制取二氧化硫。该反应的化学方程式为:

Na₂SO₃ + H₂SO₄(浓) = Na₂SO₄ + H₂O + SO₂↑
这个方程式表明,亚硫酸钠与浓硫酸反应会生成硫酸钠(Na₂SO₄)、水(H₂O)和二氧化硫气体(SO₂)。在这个反应中,亚硫酸钠作为还原剂,浓硫酸作为氧化剂,二者发生氧化还原反应,生成了硫酸钠、水和二氧化硫。
选择浓硫酸的原因在于,浓硫酸中的水分含量较少,可以减少二氧化硫在水中的溶解,从而提高二氧化硫的收集效率。此外,浓硫酸还具有吸水性,能够进一步吸收反应生成的水分,有助于获得更纯净的二氧化硫气体。
实验操作步骤通常如下:
1. 准备一个圆底烧瓶,在其中盛放适量的亚硫酸钠。
2. 准备一个分液漏斗,并在其中盛放浓硫酸。
3. 将分液漏斗中的浓硫酸逐滴加入圆底烧瓶中。这时,会立即观察到二氧化硫气体的生成,且不需要加热。
4. 当亚硫酸钠全部被酸浸湿后,气体产生的速度可能会减慢。此时,可以微微加热烧瓶,以加速反应的进行。
5. 由于二氧化硫容易与水反应,所以应使用向上排空气法收集生成的气体。
除了上述方法外,实验室中还有其他几种制取二氧化硫的方法,虽然不如亚硫酸钠与浓硫酸反应常用,但同样值得了解。
一种方法是利用硫磺(S)在燃烧条件下生成二氧化硫。该反应的化学方程式为:
S + O₂ = SO₂(点燃)
这个方程式表明,硫磺在氧气中燃烧会生成二氧化硫气体。这个反应常用于工业规模的二氧化硫生产,但在实验室中由于操作相对复杂且产生的气体量较大,因此不常使用。
另一种方法是利用硫化氢(H₂S)燃烧生成二氧化硫。该反应的化学方程式为:
2H₂S + 3O₂ = 2H₂O + 2SO₂(点燃)
这个方程式表明,硫化氢在氧气中燃烧会生成水和二氧化硫气体。与硫磺燃烧相比,硫化氢燃烧生成二氧化硫的反应在实验室中更为少见,但同样具有理论价值。
此外,加热某些含硫的化合物也可以生成二氧化硫。例如,加热硫铁矿(主要成分为FeS₂)、闪锌矿(主要成分为ZnS)或硫化汞(HgS)都可以生成二氧化硫。这些反应的化学方程式分别为:
4FeS₂ + 11O₂ = 2Fe₂O₃ + 8SO₂
2ZnS + 3O₂ = 2ZnO + 2SO₂
HgS + O₂(g)= Hg + SO₂
这些反应在工业上有广泛应用,但在实验室中由于需要高温条件和特定的反应设备,因此操作相对复杂。
在实验室制取二氧化硫时,需要注意以下几点安全事项:
1. 二氧化硫是一种有毒气体,对人体健康有害。因此,在进行实验时,应在通风橱中进行,并佩戴好防护口罩和手套。
2. 实验中使用的浓硫酸具有强烈的腐蚀性和氧化性,使用时需要特别小心,避免与皮肤或衣物直接接触。
3. 实验中产生的二氧化硫气体应使用适当的装置进行收集和处理,以防止其逸散到空气中造成污染。
4. 实验结束后,应及时清洗实验仪器,并妥善处理实验废弃物。
在实验室制取二氧化硫的过程中,还可以通过一些方法来优化实验效果。例如,选择适当的反应物和反应条件可以提高二氧化硫的生成效率和纯度。此外,还可以采用一些分离和提纯技术来进一步处理生成的二氧化硫气体,以获得更纯净的产物。
值得一提的是,二氧化硫在化学工业中具有广泛的应用。例如,它可以用作漂白剂、消毒剂和防腐剂;在食品工业中,它可以用于葡萄酒的防腐和抗氧化;在化学分析中,它可以作为还原剂参与多种化学反应。此外,二氧化硫还是一种重要的化工原料,可以用于生产硫酸、亚硫酸盐等化合物。
总之,实验室制取二氧化硫的化学方程式及其相关原理和操作是化学学习和研究中不可或缺的一部分。通过深入了解这些内容,可以更好地掌握二氧化硫的制备方法和应用领域,为未来的学习和工作打下坚实的基础。
同时,在进行实验时,应严格遵守实验室安全规定和操作规程,确保实验的顺利进行和人身安全。通过不断的实践和学习,我们可以不断提高自己的实验技能和化学素养,为化学科学的发展做出更大的贡献。
- 上一篇: 呕吐相关的多音字词组
- 下一篇: 谁是第一位获得诺贝尔奖的中国国籍获得者?
-
 实验室如何制取氧气的方法是什么?资讯攻略11-14
实验室如何制取氧气的方法是什么?资讯攻略11-14 -
 制取氧气的三种化学反应方程式资讯攻略11-14
制取氧气的三种化学反应方程式资讯攻略11-14 -
 实验室制氧气的三种方法分别是什么,对应的化学方程式是怎样的?资讯攻略11-14
实验室制氧气的三种方法分别是什么,对应的化学方程式是怎样的?资讯攻略11-14 -
 轻松掌握!制取氧气的6大实用方法详解资讯攻略11-14
轻松掌握!制取氧气的6大实用方法详解资讯攻略11-14 -
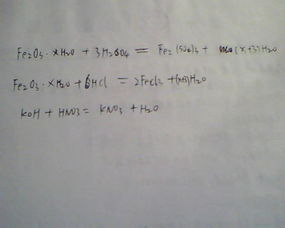 氧化铁与盐酸反应的化学及离子方程式资讯攻略02-05
氧化铁与盐酸反应的化学及离子方程式资讯攻略02-05 -
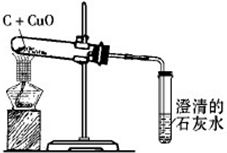 揭秘:木炭如何神奇地还原氧化铜,现象大赏!资讯攻略12-03
揭秘:木炭如何神奇地还原氧化铜,现象大赏!资讯攻略12-03